“吃货”已经成为当今社会的流行词之一,许多人喜欢戏称自己为吃货,彰显乐天心性,然而吃货也有吃货的烦恼——肥胖,过度摄食和运动量减少导致的肥胖已经成为困扰现代人的一个严峻的健康问题。近日,美国德州大学西南医学中心的研究人员在《Nature Metabolism》上发表了一篇研究论文,为人类彻底了解并治疗肥胖提供了重要的理论依据。https://doi.org/10.1038/s42255-019-0149-1白色脂肪组织(WAT)中的线粒体功能是脂肪细胞生物学的一个重要但尚未被研究的方向。在此,论文研究者报道了淀粉样蛋白前体(APP)在通过高脂饮食(HFD)诱导后,造成白色脂肪组织中线粒体非常规错误定位,损害线粒体的功能,并终促进肥胖。
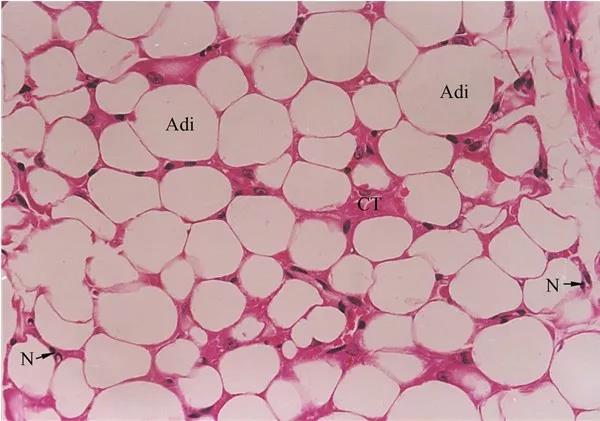
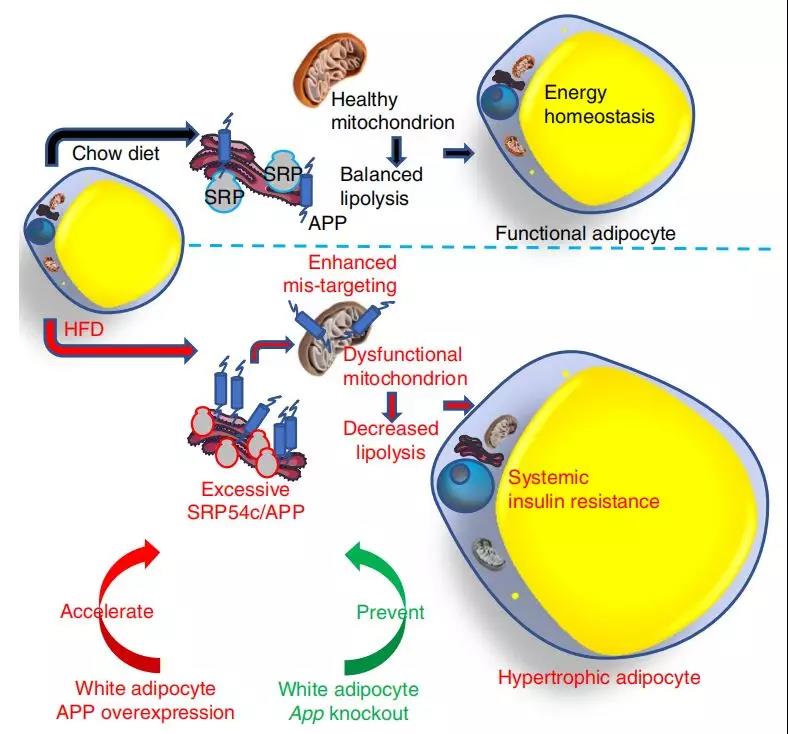
充分认知并理解导致脂肪组织(AT)功能障碍的过程,对于理解肥胖的病理生理学是至关重要的,并且可以确定预防和治疗肥胖相关性疾病的新靶点。体重增加导致AT的扩张,包括脂肪细胞过度增生,导致脂肪细胞功能受损,继而引起炎症和纤维化等病变。肥大脂肪细胞抵抗胰岛素对脂肪分解和葡萄糖摄取的作用,并表现为脂联素分泌受损,而脂联素是一种增强胰岛素敏感性的激素。肥大脂肪细胞缺氧的风险增加,因而诱导纤维化程序的启动,限制了正常AT的生长。临床研究表明脂肪细胞增大与AT功能障碍、全身代谢缺陷和全身胰岛素抵抗等相关联。皮下脂肪细胞大小的增加是肥胖相关合并症的预测指标,例如Ⅱ型糖尿病。因此,以脂肪细胞增生作为治疗方向有可能改善肥胖患者的代谢功能。脂肪细胞代谢不良的另一个特征是线粒体功能障碍,影响脂肪的生成、分泌和降解。来自人类和动物研究的证据表明,肥胖与白色脂肪组织(WAT)中的线粒体功能障碍相关,表现为线粒体DNA(mtDNA)的减少、电子传递链(ETC)基因表达降低、线粒体氧化能力受损以及活性氧(ROS)水平升高等。研究者通过在啮齿类动物中构建转基因和组织特异性敲除模型,已经鉴定了在线粒体功能上调节的几个因素,包括解偶联蛋白1(UCP1)、过氧化物酶体增殖物激活受体γ共激活因子1α(PGC1α)以及mitoNEET。APP在神经科学领域有广泛的研究,因为它通过产生有害的淀粉样β蛋白(Aβ)聚集体诱导阿尔兹海默症(AD)的发病。然而,很少有人研究APP在外周器官中的作用。值得注意的是,APP在小鼠和人类WAT中都有表达,并且高脂肪饮食(HFD)会大量诱导APP的表达。有研究曾发现系统APP缺乏导致体重下降15-20%,但其原因还不清楚。在此,研究者报道了肥胖条件下APP在脂肪细胞线粒体中的一个非常规定位,以及APP在调节脂肪细胞线粒体功能、脂肪分解和过度增生中的重要作用。研究人员建立了脂肪细胞特异性、多西环素(Dox)诱导的APP过表达和APP基因敲除小鼠模型,并通过研究发现:APP在脂肪组织中上调,并在肥胖条件下于脂肪细胞线粒体中富集。文章作者YuA. An等表示:在人类和小鼠中,肥胖会导致白色脂肪组织(WAT)中大量产生淀粉样蛋白前体(APP),同时APP会在线粒体中富集。从机制上来说,高脂饮食(HFD)诱导信号识别颗粒亚基54c的失调是淀粉样蛋白前体(APP)错误定位到脂肪细胞线粒体的原因。错误定位的淀粉样蛋白前体(APP)扰乱了蛋白质输入系统,进而导致白色脂肪组织(WAT)中的线粒体功能障碍。脂肪细胞特异性和线粒体靶向的淀粉样蛋白前体(APP)过表达小鼠,表现出体重增加、胰岛素敏感性降低以及白色脂肪组织(WAT)功能异常,这是由脂肪细胞的过度增生机制导致的。清除脂肪细胞中的淀粉样蛋白前体(APP)可以拯救因高脂饮食(HFD)受损的线粒体功能,并且具有相当大的防止体重增加和全身代谢不足的保护作用。总的来说,本论文研究者通过众多实验数据突出了淀粉样蛋白前体(APP)在调节白色脂肪组织(WAT)线粒体功能和肥胖相关代谢功能障碍中的重要作用,为人类认知引起肥胖的具体分子机制并治疗过度肥胖及预防肥胖并发症提供新思路和新方向!
参考资料:
[1] Dysregulation of amyloid precursor protein impairs adipose tissue mitochondrial function and promotes obesity