
肝细胞癌(HCC)约占肝癌病例的90%,是临床肿瘤学中第四大致命癌症类型。局部治疗,包括微创消融,在管理50%-60%的HCC病例中发挥着至关重要的作用。然而,多灶性HCC患者常面临消融不完全的风险,且复发率在5年内高达52%。残余肿瘤细胞的存在加速了肿瘤进展,影响了患者的预后。在临床实践中,经过局部治疗的晚期多灶性HCC患者通常会接受常规的系统治疗。尤其是乐伐替尼(LEN),一种多靶点激酶抑制剂,已被用作一线治疗。尽管在一小部分患者(约24.1%)中效果显著,但LEN对消融后HCC的治疗效果仍然受到其在体内非特异性积累和分布的限制。因此,迫切需要更先进的治疗药物递送策略。
巨噬细胞(MΦs)因其能够携带药物并靶向肿瘤及炎症组织,在精准医学中引起了广泛关注。近期开发了多种基于巨噬细胞的药物递送系统,利用单核细胞作为巨噬细胞搭便车载体。研究表明,这些巨噬细胞颗粒能沿着炎症因子梯度具有趋化性运动。尽管在利用天然免疫细胞进行生物医学应用方面取得了显著进展,但迄今为止尚未有研究将巨噬细胞搭便车策略与微创消融联合应用,进行肿瘤靶向治疗。因此,团队设计了一种微创消融引导巨噬细胞搭便车(MAMH)策略,通过沿HCC消融后产生的炎症梯度进行趋化,从而显著增强药物在肿瘤中的递送效率,进而增强对HCC的全身性抑制。
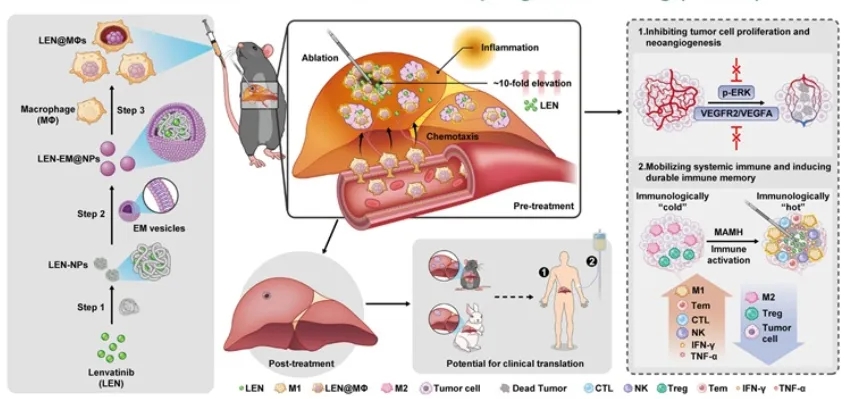
模式机理图(图片源自Hepatology)
通过M1型巨噬细胞的吞噬作用,构建了负载LEN的巨噬细胞(LEN@MΦs)。在这一过程中,LEN加载的纳米粒子被大肠杆菌膜(EM)微粒包裹,这些EM微粒通过增强巨噬细胞的吞噬效率、阻止LEN在巨噬细胞内的泄漏,并维持LEN@MΦs在免疫抑制的肿瘤微环境中的M1型特性。局部肿瘤消融会直接引发HCC细胞凋亡,同时伴随产生炎症区域。通过静脉注射,LEN@MΦs沿着趋化梯度迁移至HCC肿瘤(见Movie S1及图示)。尤其值得关注的是,使用LEN@MΦs在小鼠HCC模型中显著提高了LEN的递送效率。
为进一步验证该策略的效果,将LEN@MΦs与超声引导消融结合,在兔模型中展开研究,这一方案更贴近实际临床治疗。研究结果证实,MAMH策略在不同物种中展现出显著的抗肿瘤效果,并具有极好的生物安全性。这些结果进一步强调了MAMH策略在控制消融后残余肿瘤进展、改善HCC治疗效果方面的临床转化潜力。





